Иммунная система

Имму́нная систе́ма — система органов, существующая у позвоночных животных и объединяющая органы и ткани, которые защищают организм от заболеваний, идентифицируя и уничтожая опухолевые клетки и патогены. Иммунная система распознаёт множество разнообразных возбудителей — от вирусов до паразитических червей — и отличает их от биомолекул собственных клеток. Распознавание возбудителей усложняется их адаптацией и эволюционным развитием новых методов успешного инфицирования организма-хозяина.
Конечной целью иммунной системы является уничтожение чужеродного агента, которым может оказаться болезнетворный микроорганизм, инородное тело, ядовитое вещество или переродившаяся клетка самого организма. Этим достигается биологическая индивидуальность организма.
В иммунной системе развитых организмов существует множество способов обнаружения и удаления чужеродных агентов: этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на врождённые и приобретённые реакции. Основное различие между ними в том, что приобретённый иммунитет высокоспецифичен по отношению к конкретному типу антигенов и позволяет быстрее и эффективнее уничтожать их при повторном столкновении. Антигенами называют молекулы, воспринимаемые как чужеродные агенты и вызывающие специфические реакции организма. Например, у перенёсших ветрянку, корь, дифтерию людей часто возникает пожизненный иммунитет к этим заболеваниям. В случае аутоиммунных реакций антигеном может служить молекула, произведённая самим организмом.
Некоторые вещества, вырабатываемые иммунной системой, активно влияют на работу центральной нервной системы.
Содержание
- 1 Эволюция иммунных механизмов
- 2 Морфология иммунной системы
- 3 Многоэтапность иммунной защиты
- 4 Поверхностные барьеры
- 5 Врождённый иммунитет
- 6 Приобретённый иммунитет
- 7 Иммунологическая память
- 8 Иммунологические расстройства у человека
- 9 Другие защитные механизмы макроорганизма
- 10 Иммунология опухолей
- 11 Управление иммунной системой
- 12 История развития представлений об иммунной системе
- 13 См. также
- 14 Примечания
- 15 Ссылки
Эволюция иммунных механизмов
Защитные механизмы, направленные на распознавание и обезвреживание возбудителей, существуют даже у прокариот: например, ряд бактерий обладает ферментными системами, которые предотвращают заражение бактерии вирусом. Другие базовые иммунные механизмы развились в процессе эволюции у древних эукариот и сохранились у их современных потомков, в том числе у растений и животных. К таким механизмам относятся антимикробные пептиды, дефензины, рецепторы распознавания специфических последовательностей и система комплемента.
Короткие фрагменты РНК, которые избирательно синтезируются только в клетках половых органов (открыты в 2000-х годах), способны подавлять активность транспозонов (могут вызывать мутации при перемещении по геному) и передаются по материнской линии потомству. Потомство дрозофил получает в комплекте с ДНК такой молекулярный переключатель, который подавляет активность вредных генетических элементов.
Более сложные механизмы развились относительно недавно, в ходе эволюции позвоночных.
Иммунная система у позвоночных (например, у человека) состоит из множества видов белков, клеток, органов и тканей, взаимодействия между которыми сложны и динамичны. Благодаря такой усовершенствованной иммунной реакции система позвоночных со временем приспосабливается, и распознавание конкретных чужеродных веществ или клеток становится более эффективным. В процессе адаптации создаётся иммунологическая память, которая позволяет ещё более эффективно защищать организм при следующей встрече с этими возбудителями. Такой вид приобретённого иммунитета лежит в основе методик вакцинации.
У теплокровных сохранение гомеостаза уже обеспечивается двумя иммунными механизмами (разными по времени эволюционного появления): температура (общее воздействие) и антитела (избирательное воздействие).
Морфология иммунной системы
Иммунная система человека и других позвоночных представляет из себя комплекс органов и клеток, способных выполнять иммунологические функции. Прежде всего иммунный ответ осуществляют лейкоциты. Бо́льшая часть клеток иммунной системы происходит из кроветворных тканей. У взрослых людей развитие этих клеток начинается в костном мозге. Лишь T-лимфоциты дифференцируются внутри тимуса (вилочковой железы). Зрелые клетки расселяются в лимфоидных органах и на границах с окружающей средой, около кожи или на слизистых оболочках.
Организм животных, обладающих механизмами приобретённого иммунитета, производит множество разновидностей специфических иммунных клеток, каждая из которых отвечает за какой-то определённый антиген. Наличие большого количества разновидностей иммунных клеток необходимо для того, чтобы отражать атаки микроорганизмов, способных мутировать и изменять свой антигенный состав. Значительная часть этих клеток завершает свой жизненный цикл, так и не приняв участие в защите организма, например, не встретив подходящих антигенов.
Многоэтапность иммунной защиты
Иммунная система защищает организм от инфекции в несколько этапов, при этом с каждым этапом повышается специфичность защиты. Самая простая линия защиты представляет собой физические барьеры, которые предотвращают попадание возбудителей инфекции — бактерий и вирусов — в организм. Если возбудитель проникает через эти барьеры, промежуточную неспецифическую реакцию на него осуществляет врождённая иммунная система. Врождённая иммунная система обнаруживается у всех растений и животных. На случай, когда возбудители успешно преодолевают воздействие врождённых иммунных механизмов, у позвоночных существует третий уровень защиты — приобретённая иммунная защита. Эта часть иммунной системы адаптирует свою реакцию во время инфекционного процесса, чтобы улучшить распознавание чужеродного биологического материала. Такой улучшенный ответ сохраняется после уничтожения возбудителя в виде иммунологической памяти. Она позволяет механизмам приобретённого иммунитета развивать более быструю и более сильную ответную реакцию при каждом появлении такого же возбудителя.
| Врождённый иммунитет | Приобретённый иммунитет |
|---|---|
| Реакция неспецифична | Специфическая реакция, привязанная к чужеродному антигену |
| Столкновение с инфекцией приводит к немедленной максимальной реакции | Между контактом с инфекцией и максимальным ответом латентный период |
| Клеточные и гуморальные звенья | Клеточные и гуморальные звенья |
| Не обладает иммунологической памятью | Столкновение с чужеродным агентом приводит к иммунологической памяти |
| Обнаруживается практически у всех форм жизни | Обнаружена только у некоторых организмов |
Как врождённый, так и приобретённый иммунитет, зависят от способности иммунной системы отличать свои молекулы от чужих. В иммунологии под своими молекулами понимают те компоненты организма, которые иммунная система способна отличить от чужеродных. Напротив, чужими называют молекулы, которые распознаются как чужеродные. Один из классов "чужих" молекул называют антигенами (термин произошёл от сокращения англ. antibody generators — «вызывающие антитела») и определяют как вещества, связываемые со специфическими иммунными рецепторами и вызывающие иммунный ответ.
Поверхностные барьеры
Организмы защищены от инфекций рядом механических, химических и биологических барьеров. Примерами механических барьеров, служащих первым этапом защиты от инфекции, могут служить восковое покрытие многих листьев растений, экзоскелет членистоногих, скорлупа яиц и кожа. Однако организм не может быть полностью отграничен от внешней среды, поэтому существуют и другие системы, защищающие внешние сообщения организма — дыхательную, пищеварительную и мочеполовую системы. Эти системы можно разделить на постоянно действующие и включающиеся в ответ на вторжение. Пример постоянно действующей системы — крохотные волоски на стенках трахеи, называемые ресничками, которые совершают быстрые движения, направленные вверх, удаляя частицы пыли, пыльцу растений или другие мелкие инородные объекты, чтобы они не могли попасть в лёгкие. Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слёз и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, служит для связывания и обездвиживания микроорганизмов.
Если постоянно действующих механизмов оказывается недостаточно, то включаются «аварийные» механизмы очистки организма, такие как кашель, чихание, рвота и диарея.
Помимо этого, существуют химические защитные барьеры. Кожа и дыхательные пути выделяют антимикробные пептиды, например бета-дефензины. Такие ферменты, как лизоцим и фосфолипаза A, содержатся в слюне, слезах и грудном молоке, и также обладают антимикробным действием. Выделения из влагалища служат химическим барьером после начала менструаций, когда они становятся слабокислыми. Сперма содержит дефензины и цинк для уничтожения возбудителей. В желудке соляная кислота и протеолитические ферменты служат мощными химическими защитными факторами в отношении попавших с пищей микроорганизмов.
В мочеполовом и желудочно-кишечном трактах существуют биологические барьеры, представленные дружественными микроорганизмами — комменсалами. Приспособившаяся к обитанию в этих условиях неболезнетворная микрофлора конкурирует с патогенными бактериями за пищу и пространство, и, в ряде случаев, изменяя условия обитания, в частности pH или содержание железа. Это снижает вероятность достижения болезнетворными микробами достаточных для возникновения патологии количеств. Поскольку большая часть антибиотиков неспецифически воздействует на бактерии, и, зачастую, не затрагивает грибы, антибактериальная терапия может приводить к чрезмерному «разрастанию» грибковых микроорганизмов, что вызывает такие заболевания, как молочница (кандидоз). Есть убедительные сведения, подтверждающие, что введение пробиотической флоры, например чистых культур лактобацилл, которые содержатся, в частности, в йогурте и других кисломолочных продуктах, помогает восстановить нужный баланс микробных популяций при кишечных инфекциях у детей. Также существуют обнадёживающие данные в исследованиях применения пробиотиков при бактериальном гастроэнтерите, воспалительных заболеваниях кишечника, инфекциях мочевыводящих путей и послеоперационных инфекциях.
Врождённый иммунитет
Если микроорганизму удаётся проникнуть через первичные барьеры, он сталкивается с клетками и механизмами системы врождённого иммунитета. Врождённая иммунная защита неспецифична, то есть её звенья распознают и реагируют на чужеродные тела независимо от их особенностей. Эта система не создаёт длительной невосприимчивости к конкретной инфекции. Система врождённого иммунитета осуществляет основную защиту у большинства живых многоклеточных организмов.
Гуморальные и биохимические факторы
Воспаление
Воспаление — одна из наиболее ранних реакций иммунной системы на инфекцию. К симптомам воспаления относятся покраснение и отёк, что свидетельствует об усилении притока крови к вовлечённым в процесс тканям. В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые повреждёнными или инфицированными клетками. К эйкозаноидам относятся простагландины, вызывающие повышение температуры и расширение кровеносных сосудов, и лейкотриены, которые привлекают определённые виды белых кровяных телец (лейкоцитов). К наиболее распространённым цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами, в частности способностью угнетать синтез белка в клетках макроорганизма. Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению повреждённых тканей путём уничтожения возбудителей.
Система комплемента
Система комплемента представляет собой биохимический каскад, который атакует мембрану чужеродных клеток. В него входят более 20 различных белков. Комплемент является основным гуморальным компонентом врождённого иммунного ответа. Система комплемента имеется у многих видов, в том числе у ряда беспозвоночных.
У человека этот механизм активируется путём связывания белков комплемента с углеводами на поверхности микробных клеток, либо путём связывания комплемента с антителами, которые прикрепились к этим микробам (второй способ отражает взаимосвязь механизмов врождённого и приобретённого иммунитета). Сигнал в виде прикреплённого к мембране клетки комплемента запускает быстрые реакции, направленные на разрушение такой клетки. Скорость этих реакций обусловлена усилением, возникающим вследствие последовательной протеолитической активации молекул комплемента, которые сами по себе являются протеазами. После того, как белки комплемента прикрепились к микроорганизму, запускается их протеолитическое действие, что, в свою очередь, активирует другие протеазы системы комплемента, и так далее. Таким образом возникает каскадная реакция, усиливающая исходный сигнал при помощи управляемой положительной обратной связи. В результате каскада образуются пептиды, привлекающие иммунные клетки, усиливающие проницаемость сосудов и опсонизирующие поверхность клетки, помечая её «к уничтожению». Кроме того, отложение факторов комплемента на поверхности клетки может напрямую разрушать её посредством разрушения цитоплазматической мембраны.
Существуют три пути активации комплемента: классический, лектиновый и альтернативный. За неспецифическую реакцию врождённого иммунитета без участия антител отвечают лектиновый и альтернативный пути активации комплемента. У позвоночных комплемент также участвует в реакциях специфического иммунитета, при этом его активация обычно происходит по классическому пути.
Клеточные факторы врождённого иммунитета
Лейкоциты (белые кровяные тельца) часто ведут себя подобно независимым одноклеточным организмам, и представляют собой главное клеточное звено врождённого (гранулоциты и макрофаги) и приобретённого (в первую очередь лимфоциты, но их действия тесно связаны с клетками врождённой системы) иммунитета. К клеткам, воплощающим неспецифическую («врождённую») иммунную реакцию, относятся фагоциты (макрофаги, нейтрофилы и дендритные клетки), тучные клетки, базофилы, эозинофилы и естественные киллеры. Эти клетки распознают и уничтожают чужеродные частицы путём фагоцитоза (заглатывания и последующего внутриклеточного переваривания) либо, в случае крупных чужеродных тел (например, паразитов или крупных опухолевых клеток), путём выделения разрушительных частиц при непосредственном контакте. Кроме того, осуществляющие неспецифический иммунитет клетки являются важными посредниками в процессе активации механизмов приобретённого иммунитета.
Фагоциты

Фагоцитоз представляет собой важную особенность клеточного звена врождённого иммунитета, которую осуществляют клетки, называемые фагоцитами, которые «переваривают» чужеродные микроорганизмы или частицы. Фагоциты обычно циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определённое место при помощи цитокинов. После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком — лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов, либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются свободные радикалы. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей. Фагоцитоз, вероятно, представляет собой наиболее старую форму защиты макроорганизма, поскольку фагоциты обнаруживаются как у позвоночных, так и у беспозвоночных животных.
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности — моноциты и макрофаги), дендритные клетки и нейтрофилы. Фагоциты способны связывать микроорганизмы и антигены на своей поверхности, а затем поглощать и уничтожать их. Эта функция основана на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врождённого иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты играют важную роль в его механизмах путём представления антигенов T-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50 %-60 % общего количества циркулирующих лейкоцитов. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1. Кроме того, макрофаги выполняют роль уборщиков, избавляя организм от изношенных клеток и другого мусора, а также роль антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета.
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретённого иммунитета.
Вспомогательные клетки
Вспомогательными клетками считаются тучные клетки, базофилы, эозинофилы, тромбоциты. Также в иммунной защите участвуют соматические клетки различных тканей организма. Тучные клетки находятся в соединительной ткани и слизистых оболочках и участвуют в регуляции воспалительной реакции. Они очень часто связаны с аллергией и анафилаксией. Они во многом напоминают базофилы — одну из малочисленных подгрупп зернистых лейкоцитов. Базофилы и эозинофилы родственны нейтрофилам. Эозинофилы секретируют биохимические медиаторы, которые участвуют в защите от крупных многоклеточных паразитов, а также играют роль в аллергических реакциях, например при бронхиальной астме. Естественные киллеры (или натуральные, или нормальные, от англ. Natural killer) представляют собой лейкоциты группы лимфоцитов, которые атакуют и уничтожают опухолевые клетки, или инфицированные вирусами клетки.
Приобретённый иммунитет
Система приобретённого иммунитета появилась в ходе эволюции низших позвоночных. Она обеспечивает более интенсивный иммунный ответ, а также иммунологическую память, благодаря которой каждый чужеродный микроорганизм «запоминается» по уникальным для него антигенам. Система приобретённого иммунитета антигенспецифична и требует распознавания специфических чужих («не своих») антигенов в процессе, называемом презентацией антигена. Специфичность антигена позволяет осуществлять реакции, которые предназначены конкретным микроорганизмам или инфицированным ими клеткам. Способность к осуществлению таких узконаправленных реакций поддерживается в организме «клетками памяти». Если макроорганизм инфицируется микроорганизмом более одного раза, эти специфические клетки памяти используются для быстрого уничтожения такого микроорганизма.
Лимфоциты
Клетки иммунной системы, на которые возложены ключевые функции по осуществлению приобретённого иммунитета, относятся к лимфоцитам, которые являются подтипом лейкоцитов. Большая часть лимфоцитов отвечает за специфический приобретённый иммунитет, так как могут распознавать возбудителей инфекции внутри или вне клеток, в тканях или в крови.
Основными типами лимфоцитов являются B-клетки и T-клетки, которые происходят из плюрипотентных гемопоэтических стволовых клеток; у взрослого человека они образуются в костном мозге, а T-лимфоциты дополнительно проходят часть этапов дифференцировки в тимусе. B-клетки отвечают за гуморальное звено приобретённого иммунитета, то есть вырабатывают антитела, в то время как T-клетки представляют собой основу клеточного звена специфического иммунного ответа.
В организме предшественники лимфоцитов непрерывно продуцируются в ходе дифференциации стволовых кроветворных клеток, при этом вследствие мутаций генов, кодирующих вариабельные цепи антител, возникает множество клеток, чувствительных к множеству потенциально существующих антигенов. На этапе развития лимфоциты проходят отбор: остаются только значимые с точки зрения защиты организма, а также те, которые не несут угрозы собственным тканям организма. Параллельно с этим процессом лимфоциты разделяются на группы, способные выполнять ту или иную функцию защиты. Существуют разные виды лимфоцитов. В частности, по морфологическим признакам их разделяют на малые лимфоциты и большие гранулярные лимфоциты (БГЛ). По структуре внешних рецепторов среди лимфоцитов выделяют, в частности, B-лимфоциты и T-лимфоциты.
Как B-, так и T-клетки несут на своей поверхности рецепторные молекулы, которые распознают специфические мишени. Рецепторы представляют из себя как бы «зеркальный отпечаток» определённой части чужеродной молекулы, способный присоединяться к ней. При этом одна клетка может содержать рецепторы только для одного вида антигенов.
T-клетки распознают чужеродные («не-свои») мишени, такие как патогенные микроорганизмы, только после того, как антигены (специфические молекулы чужеродного тела) будут обработаны и презентированы в сочетании с собственной («своей») биомолекулой, которая называется молекулой главного комплекса гистосовместимости (англ. major histocompatibility complex, MHC). Среди T-клеток различают ряд подтипов, в частности, Т-киллеры, Т-хелперы и регуляторные Т-клетки.
T-киллеры распознают только антигены, которые объединены с молекулами главного комплекса гистосовместимости I класса, в то время как T-хелперы распознают только антигены, расположенные на поверхности клеток в сочетании с молекулами главного комплекса гистосовместимости II класса. Это различие в презентации антигена отражает разные роли указанных двух типов T-клеток. Другим, менее распространённым подтипом T-клеток, являются γδ T-клетки, которые распознают неизменённые антигены, не связанные с рецепторами главного комплекса гистосовместимости.
У T-лимфоцитов круг задач весьма широк. Часть из них — регуляция приобретённого иммунитета с помощью специальных белков (в частности, цитокинов), активация B-лимфоцитов для образования антител, а также регуляция активации фагоцитов для более эффективного разрушения микроорганизмов. Эту задачу выполняет группа T-хелперов. За разрушение собственных клеток организма путём выделения цитотоксичных факторов при непосредственном контакте отвечают T-киллеры, которые действуют специфически.
В отличие от T-клеток, B-клетки не нуждаются в обработке антигена и экспрессии его на поверхности клетки. Их рецепторы к антигену представляют собой фиксированные на поверхности B-клетки антителоподобные белки. Каждая прошедшая дифференцировку линия B-клеток экспрессирует уникальное только для неё антитело, и никакое другое. Таким образом, полный набор антигенных рецепторов всех B-клеток организма представляет все антитела, которые организм может вырабатывать. Функция B-лимфоцитов заключается прежде всего в выработке антител — гуморального субстрата специфического иммунитета, — действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
Кроме того, существуют лимфоциты, неспецифически проявляющие цитотоксичность — естественные киллеры.
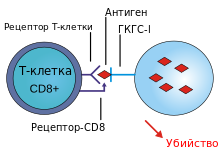
T-киллеры
Т-киллеры представляют собой подгруппу T-клеток, функцией которых является разрушение собственных клеток организма, инфицированных вирусами или другими патогенными внутриклеточными микроорганизмами, либо клеток, которые повреждены или неверно функционируют (например, опухолевые клетки). Как и B-клетки, каждая конкретная линия T-клеток распознает только один антиген. T-киллеры активируются при соединении своим T-клеточным рецептором (ТКР) со специфическим антигеном в комплексе с рецептором главного комплекса гистосовместимости I класса другой клетки. Распознавание этого комплекса рецептора гистосовместимости с антигеном осуществляется при участии расположенного на поверхности T-клетки вспомогательного рецептора CD8. В лабораторных условиях T-клетки обычно выявляют именно по экспрессии CD8. После активации T-клетка перемещается по организму в поисках клеток, на которых белок I класса главного комплекса гистосовместимости содержит последовательность нужного антигена. При контакте активированного T-киллера с такими клетками он выделяет токсины, образующие отверстия в цитоплазматической мембране клеток-мишеней, в результате ионы, вода и токсин свободно перемещаются в клетку-мишень и из неё: клетка-мишень погибает. Разрушение собственных клеток T-киллерами важно, в частности, для предотвращения размножения вирусов. Активация T-киллеров жёстко управляется и обычно требует очень сильного сигнала активации от комплекса белка гистосовместимости с антигеном, либо дополнительной активации факторами T-хелперов.
T-хелперы
Т-хелперы регулируют реакции как врождённого, так и приобретённого иммунитета, и позволяют определять тип ответа, который организм окажет на конкретный чужеродный материал. Эти клетки не проявляют цитотоксичности и не участвуют в уничтожении инфицированных клеток или непосредственно возбудителей. Вместо этого, они управляют иммунным ответом, направляя другие клетки на выполнение этих задач.
T-хелперы экспрессируют T-клеточные рецепторы (ТКР), которые распознают антигены, связанные с молекулами II класса главного комплекса гистосовместимости. Комплекс молекулы главного комплекса гистосовместимости с антигеном также распознается корецептором клеток-хелперов CD4, который привлекает внутриклеточные молекулы T-клетки (например, Lck), ответственные за активацию T-клетки. T-хелперы обладают меньшей чувствительностью к комплексу молекулы главного комплекса гистосовместимости и антигена, чем T-киллеры, то есть для активации T-хелпера требуется связывание гораздо большего количества его рецепторов (около 200—300) с комплексом молекулы гистосовместимости и антигена, в то время как T-киллеры могут быть активированы после связывания с одним таким комплексом. Активация T-хелпера также требует более продолжительного контакта с антиген-презентирующей клеткой. Активация неактивного T-хелпера приводит к высвобождению им цитокинов, которые оказывают влияние на активность многих видов клеток. Цитокиновые сигналы, создаваемые T-хелперами, усиливают бактерицидную функцию макрофагов и активность T-киллеров. Кроме того, активация T-хелперов вызывает изменения в экспрессии молекул на поверхности T-клетки, в частности лиганда CD40 (также известного под обозначением CD154), что создаёт дополнительные стимулирующие сигналы, обычно требуемые для активации вырабатывающих антитела B-клеток.
Гамма-дельта T-клетки
5-10 % T-клеток несут на своей поверхности гамма-дельта-ТКР и обозначаются как γδ T-клетки.
B-лимфоциты и антитела
В-клетки составляют 5-15 % циркулирующих лимфоцитов и характеризуются поверхностными иммуноглобулинами, встроенными в клеточную мембрану и выполняющими функцию специфического антигенного рецептора. Этот рецептор, специфичный лишь для определённого антигена, называется антителом. Антиген, связываясь с соответствующим антителом на поверхности В-клетки, индуцирует пролиферацию и дифференцировку В-клетки до плазматических клеток и клеток памяти, специфичность которых такая же, как и специфичность исходной В-клетки. Плазматические клетки секретируют большое количество антител в виде растворимых молекул, распознающих исходный антиген. Секретируемые антитела имеют ту же специфичность, что и соответствующий В-клеточный рецептор.
Антигенпрезентирующие клетки
Иммунологическая память
Иммунологическая память — это способность иммунной системы отвечать более быстро и эффективно на антиген (патоген), с которым у организма был предварительный контакт.
Такая память обеспечивается предсуществующими антигенспецифическими клонами как В-клеток, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определённому антигену.
Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации.
Иммунологические расстройства у человека
Иммунодефициты
Иммунодефициты (ИДС) — это нарушения иммунологической реактивности, которые обусловлены выпадением одного или нескольких компонентов иммунного аппарата или тесно взаимодействующих с ним неспецифических факторов.
Аутоиммунные процессы
Аутоиммунные процессы — это в значительной степени хронические явления, которые приводят к долговременному повреждению тканей. Это связано в первую очередь с тем, что аутоиммунная реакция постоянно поддерживается тканевыми антигенами.
Гиперчувствительность
Гиперчувствительность — это термин, используемый для обозначения иммунного ответа, который протекает в аггравированной и неадекватной форме, в результате чего происходит повреждение тканей.
Другие защитные механизмы макроорганизма
Иммунология опухолей
К аспектам иммунологии опухолей относятся три основных направления исследований:
- Использование методов иммунологии для диагностики опухолей, определения прогноза и выработки тактики лечения заболевания;
- Осуществление иммунотерапии в качестве дополнения к другим видам лечения и для иммунокоррекции — восстановления деятельности иммунной системы;
- Определение роли иммунологического наблюдения за опухолями у человека.
Управление иммунной системой
Физиологические механизмы
Применяемые в медицине методы воздействия

Существует несколько методов влияния на иммунный ответ для подавления нежелательных эффектов, вызываемых аутоиммунными заболеваниями, аллергиями, пересадкой органов, либо для стимулирования защитного ответа против определенных патогенов (иммунизация при помощи вакцин) или отдельных видов опухолей.
Иммуносупрессия
Иммуносупрессия (иммунодепрессия) — угнетение иммунитета с помощью лекарственных препаратов (иммуносупрессоров) при аутоиммунных заболеваниях или воспалениях, при которых происходит избыточное повреждение тканей. Длительная постоянная иммуносупрессия необходима после пересадки органов для предотвращения отторжения органа.
Противовоспалительные лекарственные средства часто применяются для управления эффектами воспаления. Наиболее сильное действие среди них оказывают Глюкокортикоиды, однако они часто имеют нежелательные побочные эффекты, и их применение требует контроля. В малых дозах противовоспалительные средства применяются вместе с цитотоксинами или иммуносупрессорами (например Метотрексат или Азатиоприн).
Цитотоксические препараты применяемые в химиотерапии подавляют иммунный ответ, препятствуя размножению определенных видов клеток, в частности, активированных T-лимфоцитов. Такие препараты воздействуют на все активно делящиеся клетки и органы, их содержащие, что вызывает серьезные побочные эффекты. Некоторые иммуносупрессоры, например Циклоспорин, действует на Т-лимфоциты, подавляя некоторые пути передачи сигнала.
Иммуностимуляция
Существует несколько видов иммунотерапии опухолей, при которой стимулируется атака иммунной системы против новообразований.
Вакцинация позволяет выработать иммунитет к ряду инфекционных заболеваний.
Механизмы обхода иммунитета возбудителями
История развития представлений об иммунной системе
В 1796 году английский учёный Эдвард Дженнер (1749—1823) разработал способ искусственной иммунизации против оспы путём заражения человека коровьей оспой.
Открытие Луи Пастера (1880) дало начало иммунологии как самостоятельной науке. Пастер обнаружил, что иммунизация кур старой холерной культурой создаёт у них устойчивость к заражению высоковирулентным возбудителем куриной холеры и сформулировал основной принцип создания вакцин, а также получил вакцины против сибирской язвы и против бешенства.
Илья Ильич Мечников открыл феномен фагоцитоза (1887) и создал клеточную или фагоцитарную теорию иммунитета.
Немецкий учёный Пауль Эрлих выдвинул гуморальную теорию иммунитета. С 1898 по 1899 год бельгийский учёный Жюль Борде и русский учёный Н. Н. Чистович обнаружили образование антител в ответ на введение чужеродных эритроцитов и сывороточных белков. Данное открытие положило начало неинфекционной иммунологии.
В 1900 году австрийский иммунолог Карл Ландштейнер сделал открытие групп крови человека. Он создал основу учения о тканевых изоантигенах.